Blood Direct PCR -kit
Funktioner
■ Enkel og hurtig: PCR -amplifikation kan udføres direkte ved hjælp af blod som skabelon uden behov for de kedelige trin i prøveforberedelse og DNA -ekstraktion.
■ Høj renhed: Springet over prøveforbehandling og DNA-ekstraktionstrin kan hjælpe med at undgå krydskontaminering af prøver.
■ Høj gennemstrømning: PCR-identifikationen for store prøver kan udføres ved at kombinere sættet med 96/384-brønds PCR-plader.
■ Stærk universalitet: Dette kit kan effektivt forstærke høje GC -fragmenter eller fragmenter med kompleks sekundær struktur, og amplifikationslængden kan være op til 5 kb.
■ Kraftig modstandsdygtighed over for stress: Dette kit kan anvendes til forskellige arter og blodprøver bevaret på forskellige måder.
Ansøgninger
PCR-produkterne i dette kit indeholder “A” i 3′-enden, som kan bruges direkte til TA-vektorkloning. Dette kit kan bruges til amplifikation af genomiske DNA-fragmenter, genetisk analyse med høj gennemstrømning og genotyping (såsom genpåvisning) analyse.
Alle produkterne kan tilpasses til ODM/OEM. For detaljer,klik venligst på Tilpasset service (ODM/OEM)
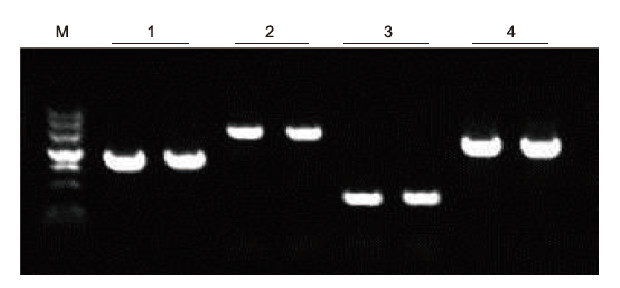 |
Ved anvendelse af human EDTA -antikoagulering som en skabelon blev 4 gener med forskelligt GC -indhold amplificeret med Blood Direct PCR Kit. PCR -reaktionssystemet var 20 pi, og 1 pi blod blev brugt som skabelon. M: TIANGEN Marker II; 1: Fragmentstørrelse 1090 bp, GC -indhold 68,1%; 2: Fragmentstørrelse 1915 bp, GC -indhold 70,4%; 3: Fragmentstørrelse 448 bp, GC -indhold 74,8%; 4: Fragmentstørrelse 1527 bp, GC -indhold 61,5%. Eksperimentelle resultater: Blood Direct PCR-kit kan effektivt amplificere DNA-fragmenter med GC-indholdet i området 61,5%-74,8%, hvilket tyder på, at det er i stand til at forstærke fragmenter med høj GC. |
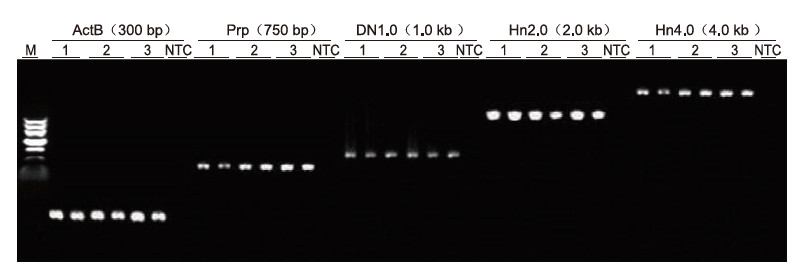 |
Ved anvendelse af human EDTA -antikoagulering som skabelon blev 5 gener med forskellige længder (ActB, Prp, DN1.0, Hn2.0 og Hn4.0) amplificeret med Blood Direct PCR Kit. PCR -reaktionssystemet var 20 pi, og 1 pi blod blev brugt som skabelon. M: TIANGEN Marker II; 1-3: 3 forskellige blodprøver; NTC: kontrol uden primere. Eksperimentelle resultater: Blood Direct PCR Kit kan forstærke fragmenter med en længde på op til 4 kb, hvilket tyder på, at det er i stand til at forstærke lange fragmenter. |
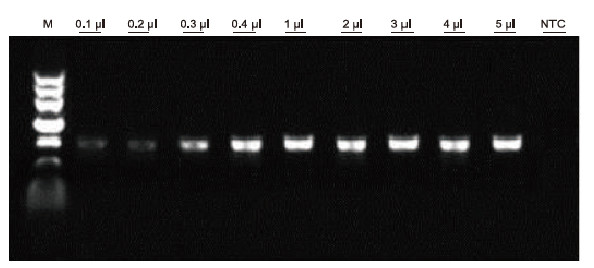 |
Ved anvendelse af human EDTA -antikoagulering som skabelon blev Blood Direct PCR -kit brugt til PCR -påvisning af forskellige blodprøver. PCR -reaktionssystemet var 20 pi, og 1 pi blod blev brugt som skabelon. M: TIANGEN Marker II; 1-9: blodmængden er henholdsvis 0,1 pi, 0,2 pi, 0,3 pi, 0,4 pi, 1 pi, 2 pi, 3 pi, 4 pi og 5 pi; NTC: kontrol uden skabelon Eksperimentelle resultater: Blood Direct PCR Kit har stærk modstandsdygtighed over for blod og kan forstærke blodprøver med et belastningsinterval på 0,1-5 μl. |
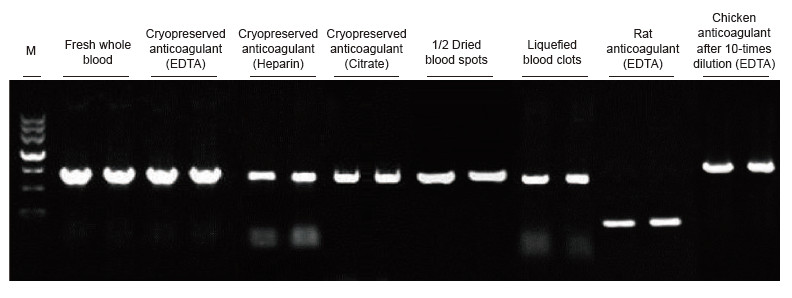 |
Blodprøver fra mennesker, rotter, kyllinger og andre arter med forskellige behandlinger blev brugt som skabeloner. Blood Direct PCR-kit blev brugt til at amplificere PRNP (human, 750 bp), Actin (rotte, 200 bp) og β-Actin (Chicken, 1,0 kb). PCR -reaktionssystemet var 20 pi, og 1 pi blod blev brugt som skabelon. M: TIANGEN Marker II. Eksperimentelle resultater: Blood Direct PCR -kit kan anvendes på en lang række prøver, og den direkte PCR -detektion kan udføres på blodprøver fra forskellige arter med forskellige behandlinger. |
A-1 skabelon
■ Skabelonen indeholder protein -urenheder eller Taq -hæmmere osv. —— Rens DNA -skabelon, fjern protein -urenheder eller ekstraher skabelon -DNA med oprensningssæt.
■ Denatureringen af skabelonen er ikke fuldført —— Forøget denatureringstemperatur passende og forlæng denatureringstiden.
■ Nedbrydning af skabeloner —— Forbered skabelonen igen.
A-2 Primer
■ Dårlig kvalitet af primere —— Re-syntetisere primeren.
■ Nedbrydning af primer —— Alikvoter primerne med høj koncentration i lille volumen til konservering. Undgå flere frysninger og optøninger eller langtids 4 ° C kryokonserveret.
■ Ukorrekt udformning af primere (f.eks. Primerlængde ikke tilstrækkelig, dimer dannet mellem primere osv.) -Rediger primere (undgå dannelse af primer -dimer og sekundær struktur)
A-3 mg2+koncentration
■ Mg2+ koncentrationen er for lav —— Korrekt stigning Mg2+ koncentration: Optimer Mg2+ koncentration ved en række reaktioner fra 1 mM til 3 mM med et interval på 0,5 mM for at bestemme den optimale Mg2+ koncentration for hver skabelon og primer.
A-4 Udglødningstemperatur
■ Den høje udglødningstemperatur påvirker bindingen af primer og skabelon. —— Reducer udglødningstemperaturen, og optimer tilstanden med en gradient på 2 ° C.
A-5 Forlængelsestid
■ Kort forlængelsestid —— Forlæng forlængelsestiden.
Fænomener: Negative prøver viser også målsekvensbåndene.
A-1 Forurening af PCR
■ Krydsforurening af målsekvens eller amplifikationsprodukter —— Forsøg ikke at pipette prøven, der indeholder målsekvensen, i den negative prøve eller spilde dem ud af centrifugerøret. Reagenserne eller udstyret skal autoklaveres for at fjerne eksisterende nukleinsyrer, og forekomsten af kontaminering bør bestemmes gennem negative kontrolforsøg.
■ Kontaminering af reagenser —— Alikvoter reagenserne, og opbevar dem ved lav temperatur.
A-2 Primer
■ Mg2+ koncentrationen er for lav —— Korrekt stigning Mg2+ koncentration: Optimer Mg2+ koncentration ved en række reaktioner fra 1 mM til 3 mM med et interval på 0,5 mM for at bestemme den optimale Mg2+ koncentration for hver skabelon og primer.
■ Forkert primerdesign, og målsekvensen har homologi med ikke-målsekvensen. —— Re-design primere.
Fænomener: PCR-amplifikationsbåndene er uforenelige med den forventede størrelse, enten store eller små, eller nogle gange forekommer både specifikke amplifikationsbånd og uspecifikke amplifikationsbånd.
A-1 Primer
■ Dårlig primerspecificitet
—— Re-design primer.
■ Primer -koncentrationen er for høj —— Forøg korrekt denatureringstemperaturen og forlæng denatureringstiden.
A-2 mg2+ koncentration
■ Mg2+ koncentrationen er for høj —— Reducer Mg2+ -koncentrationen korrekt: Optimer Mg2+ koncentration ved en række reaktioner fra 1 mM til 3 mM med et interval på 0,5 mM for at bestemme den optimale Mg2+ koncentration for hver skabelon og primer.
A-3 termostabil polymerase
■ Overdreven enzymmængde —— Reducer enzymmængden passende med intervaller på 0,5 U.
A-4 Udglødningstemperatur
■ Glødningstemperaturen er for lav —— Hæv glødetemperaturen passende, eller anvend to-trins glødemetoden
A-5 PCR-cyklusser
■ For mange PCR -cykler —— Reducer antallet af PCR -cyklusser.
A-1 Primer——Dårlig specificitet —— Gendesign primeren, ændr primerens position og længde for at forbedre dens specificitet; eller udføre indlejret PCR.
A-2 Skabelon-DNA
——Skabelonen er ikke ren —— Rens skabelonen, eller udtræk DNA med rensningssæt.
A-3 mg2+ koncentration
——Mg2+ koncentrationen er for høj —— Reducer Mg korrekt2+ koncentration: Optimer Mg2+ koncentration ved en række reaktioner fra 1 mM til 3 mM med et interval på 0,5 mM for at bestemme den optimale Mg2+ koncentration for hver skabelon og primer.
A-4 dNTP
—— Koncentrationen af dNTP’er er for høj —— Reducer koncentrationen af dNTP på passende vis
A-5 Udglødningstemperatur
——For lav udglødningstemperatur —— Forøg passende udglødningstemperatur
A-6 cykler
——For mange cykler ——Optimér cyklustallet

Det første trin er at vælge den passende polymerase. Regelmæssig Taq-polymerase kan ikke korrekturlæses på grund af mangel på 3'-5 'exonukleaseaktivitet, og mismatch vil i høj grad reducere forlængelseseffektiviteten af fragmenter. Derfor kan almindelig Taq -polymerase ikke effektivt amplificere målfragmenter større end 5 kb. Taq -polymerase med særlig modifikation eller anden højfidelitetspolymerase bør vælges for at forbedre forlængelseseffektivitet og opfylde behovene ved langfragmentforstærkning. Derudover kræver amplifikation af lange fragmenter også tilsvarende justering af primerdesign, denatureringstid, forlængelsestid, buffer-pH osv. Normalt kan primere med 18-24 bp føre til bedre udbytte. For at forhindre skabelonskade bør denatureringstiden ved 94 ° C reduceres til 30 sekunder eller mindre pr. Cyklus, og tiden til at stige temperaturen til 94 ° C før forstærkning bør være mindre end 1 min. Desuden kan indstilling af forlængelsestemperaturen til ca. 68 ° C og design af forlængelsestiden i henhold til hastigheden på 1 kb/min sikre effektiv forstærkning af lange fragmenter.
Fejlhastigheden ved PCR -amplifikation kan reduceres ved anvendelse af forskellige DNA -polymeraser med høj kvalitet. Blandt alle de Taq DNA -polymeraser, der er fundet indtil nu, har Pfu -enzym den laveste fejlrate og den højeste troværdighed (se vedhæftede tabel). Ud over enzymudvælgelse kan forskere yderligere reducere PCR -mutationshastighed ved at optimere reaktionsbetingelser, herunder optimering af buffersammensætning, koncentration af termostabil polymerase og optimering af PCR -cyklustal.
Produkter kategorier
HVORFOR VÆLGE OS
Siden etableringen har vores fabrik udviklet produkter i verdensklasse med overholdelse af princippet
af kvalitet først. Vores produkter har opnået et fremragende ry i branchen og er værdifulde blandt nye og gamle kunder.








