Golden Easy PCR System (med farvestof)
Funktioner
■ God stabilitet: Unik formel gør hele reaktionssystemet meget stabilt. Systemet indeholder komponenter, der er nødvendige for effektiv PCR -amplifikation, såsom termostabil DNA -polymerase, dNTP'er, MgCl2 og bufferopløsning, samt en række specielle stabilisatorer, som i høj grad øger stabiliteten af polymerasen og dNTP ved normal temperatur og 4 ℃.
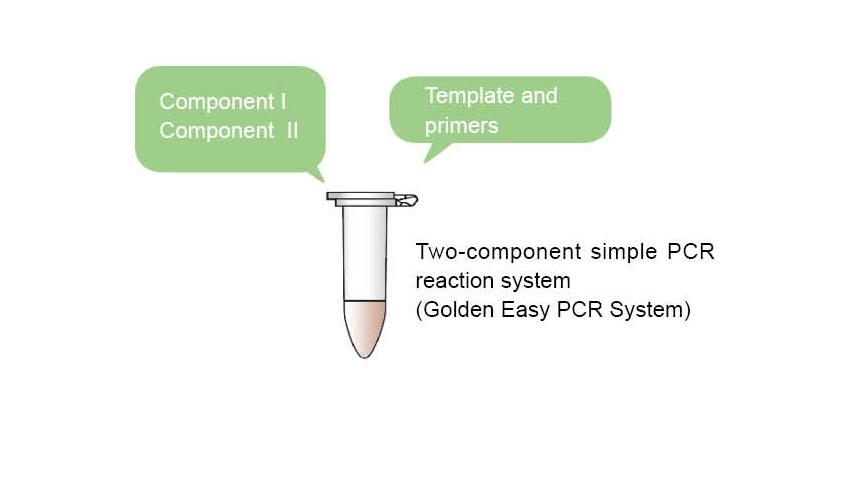
■ Hurtig og enkel: Enkel og hurtig betjening. Bland blot de to komponenter i proportion og tilføj derefter skabeloner og primere for at oprette reaktionen, undgå de kedelige trin med at tilføje forskellige PCR -reaktionskomponenter en efter en. Minimer prøveudtagningsfejl og krydskontaminering, med lidt fejl mellem forskellige partier, og kan bruges i semi-kvantitative eksperimenter.
■ Bred anvendelse og høj følsomhed.
■ Hvert reaktionssystem indeholder farvestoffer, og elektroforese kan udføres direkte efter PCR-trin, så proceduren er hurtig og arbejdsbesparende.
Kvalitetskontrol
Renheden af SDS-PAGE er mere end 99%; Ingen aktivitet af eksogen nuklease påvises; Enkeltgen i humant genom kunne amplificeres effektivt; Ingen signifikant aktivitetsændring, når den opbevares ved stuetemperatur i en uge.
Stabilitet
Produktet, der anvender det tokomponente simple PCR-system, kan opbevares ved 4 ° C i en måned uden åbenbar aktivitetændring.
Workflow
Trin 1: Bland forskellige komponenter i forhold.
Trin 2: Start eksperimentet med det samme.
Trin 3: Direkte elektroforese til blandingen med farvestoffer.
Trin 4: Tilfredsstillende eksperimentelle resultater.
Alle produkterne kan tilpasses til ODM/OEM. For detaljer,klik venligst på Tilpasset service (ODM/OEM)
 |
Det tokomponente simple PCR-system (Golden Easy PCR System) anvendes. Reaktionssystemet er 50 pi (Hvis reaktionssystemerne er forskellige, skal du øge eller reducere mængden af reaktionskomponenter, der henviser til dette system, proportionalt). |
 |
Slutreaktionskoncentration |
A-1 skabelon
■ Skabelonen indeholder protein -urenheder eller Taq -hæmmere osv. —— Rens DNA -skabelon, fjern protein -urenheder eller ekstraher skabelon -DNA med oprensningssæt.
■ Denatureringen af skabelonen er ikke fuldført —— Forøget denatureringstemperatur passende og forlæng denatureringstiden.
■ Nedbrydning af skabeloner —— Forbered skabelonen igen.
A-2 Primer
■ Dårlig kvalitet af primere —— Re-syntetisere primeren.
■ Nedbrydning af primer —— Alikvoter primerne med høj koncentration i lille volumen til konservering. Undgå flere frysninger og optøninger eller langtids 4 ° C kryokonserveret.
■ Ukorrekt udformning af primere (f.eks. Primerlængde ikke tilstrækkelig, dimer dannet mellem primere osv.) -Rediger primere (undgå dannelse af primer -dimer og sekundær struktur)
A-3 mg2+koncentration
■ Mg2+ koncentrationen er for lav —— Korrekt stigning Mg2+ koncentration: Optimer Mg2+ koncentration ved en række reaktioner fra 1 mM til 3 mM med et interval på 0,5 mM for at bestemme den optimale Mg2+ koncentration for hver skabelon og primer.
A-4 Udglødningstemperatur
■ Den høje udglødningstemperatur påvirker bindingen af primer og skabelon. —— Reducer udglødningstemperaturen, og optimer tilstanden med en gradient på 2 ° C.
A-5 Forlængelsestid
■ Kort forlængelsestid —— Forlæng forlængelsestiden.
Fænomener: Negative prøver viser også målsekvensbåndene.
A-1 Forurening af PCR
■ Krydsforurening af målsekvens eller amplifikationsprodukter —— Forsøg ikke at pipette prøven, der indeholder målsekvensen, i den negative prøve eller spilde dem ud af centrifugerøret. Reagenserne eller udstyret skal autoklaveres for at fjerne eksisterende nukleinsyrer, og forekomsten af kontaminering bør bestemmes gennem negative kontrolforsøg.
■ Kontaminering af reagenser —— Alikvoter reagenserne, og opbevar dem ved lav temperatur.
A-2 Primer
■ Mg2+ koncentrationen er for lav —— Korrekt stigning Mg2+ koncentration: Optimer Mg2+ koncentration ved en række reaktioner fra 1 mM til 3 mM med et interval på 0,5 mM for at bestemme den optimale Mg2+ koncentration for hver skabelon og primer.
■ Forkert primerdesign, og målsekvensen har homologi med ikke-målsekvensen. —— Re-design primere.
Fænomener: PCR-amplifikationsbåndene er uforenelige med den forventede størrelse, enten store eller små, eller nogle gange forekommer både specifikke amplifikationsbånd og uspecifikke amplifikationsbånd.
A-1 Primer
■ Dårlig primerspecificitet
—— Re-design primer.
■ Primer -koncentrationen er for høj —— Forøg korrekt denatureringstemperaturen og forlæng denatureringstiden.
A-2 mg2+ koncentration
■ Mg2+ koncentrationen er for høj —— Reducer Mg2+ -koncentrationen korrekt: Optimer Mg2+ koncentration ved en række reaktioner fra 1 mM til 3 mM med et interval på 0,5 mM for at bestemme den optimale Mg2+ koncentration for hver skabelon og primer.
A-3 termostabil polymerase
■ Overdreven enzymmængde —— Reducer enzymmængden passende med intervaller på 0,5 U.
A-4 Udglødningstemperatur
■ Glødningstemperaturen er for lav —— Hæv glødetemperaturen passende, eller anvend to-trins glødemetoden
A-5 PCR-cyklusser
■ For mange PCR -cykler —— Reducer antallet af PCR -cyklusser.
A-1 Primer——Dårlig specificitet —— Gendesign primeren, ændr primerens position og længde for at forbedre dens specificitet; eller udføre indlejret PCR.
A-2 Skabelon-DNA
——Skabelonen er ikke ren —— Rens skabelonen, eller udtræk DNA med rensningssæt.
A-3 mg2+ koncentration
——Mg2+ koncentrationen er for høj —— Reducer Mg korrekt2+ koncentration: Optimer Mg2+ koncentration ved en række reaktioner fra 1 mM til 3 mM med et interval på 0,5 mM for at bestemme den optimale Mg2+ koncentration for hver skabelon og primer.
A-4 dNTP
—— Koncentrationen af dNTP’er er for høj —— Reducer koncentrationen af dNTP på passende vis
A-5 Udglødningstemperatur
——For lav udglødningstemperatur —— Forøg passende udglødningstemperatur
A-6 cykler
——For mange cykler ——Optimér cyklustallet

Det første trin er at vælge den passende polymerase. Regelmæssig Taq-polymerase kan ikke korrekturlæses på grund af mangel på 3'-5 'exonukleaseaktivitet, og mismatch vil i høj grad reducere forlængelseseffektiviteten af fragmenter. Derfor kan almindelig Taq -polymerase ikke effektivt amplificere målfragmenter større end 5 kb. Taq -polymerase med særlig modifikation eller anden højfidelitetspolymerase bør vælges for at forbedre forlængelseseffektivitet og opfylde behovene ved langfragmentforstærkning. Derudover kræver amplifikation af lange fragmenter også tilsvarende justering af primerdesign, denatureringstid, forlængelsestid, buffer-pH osv. Normalt kan primere med 18-24 bp føre til bedre udbytte. For at forhindre skabelonskade bør denatureringstiden ved 94 ° C reduceres til 30 sekunder eller mindre pr. Cyklus, og tiden til at stige temperaturen til 94 ° C før forstærkning bør være mindre end 1 min. Desuden kan indstilling af forlængelsestemperaturen til ca. 68 ° C og design af forlængelsestiden i henhold til hastigheden på 1 kb/min sikre effektiv forstærkning af lange fragmenter.
Fejlhastigheden ved PCR -amplifikation kan reduceres ved anvendelse af forskellige DNA -polymeraser med høj kvalitet. Blandt alle de Taq DNA -polymeraser, der er fundet indtil nu, har Pfu -enzym den laveste fejlrate og den højeste troværdighed (se vedhæftede tabel). Ud over enzymudvælgelse kan forskere yderligere reducere PCR -mutationshastighed ved at optimere reaktionsbetingelser, herunder optimering af buffersammensætning, koncentration af termostabil polymerase og optimering af PCR -cyklustal.
Produkter kategorier
HVORFOR VÆLGE OS
Siden etableringen har vores fabrik udviklet produkter i verdensklasse med overholdelse af princippet
af kvalitet først. Vores produkter har opnået et fremragende ry i branchen og er værdifulde blandt nye og gamle kunder.








