FastKing RT -kit (med gDNase)
Funktioner
■ Høj effektivitet: FastKing RT -enzymet er modificeret med hydrofobt motiv, med RT -effektivitet på mere end 95%.
■ Følsom: Så lave som 1 ng skabeloner kan identificeres nøjagtigt.
■ Modstand: Kan reversere transskription af komplekse skabeloner med perfekt modstandsdygtighed over for urenheder.
■ Fleksibel: Genomisk DNA -fjernelse og revers transkription blev afsluttet separat. Primere blev blandet separat i et rør, fleksibelt for at ændre andre primere.
Specifikation
Type: Genmodificeret revers transkriptase, gDNase
Procedurer: To-trins (genomisk DNA-fjernelse og RT)
RT -effektivitet:> 95%
Skabelon: 1 ng- 2 μg
Driftstid: ~ 21 min
Applikationer: Det omvendte transkriberede cDNA kan bruges i konventionel PCR, realtid PCR, cDNA bibliotekskonstruktion.
21 min reaktion i et rør
Det tager kun 21 minutter at fuldføre gDNA -fjernelse og effektiv omvendt transkriptionsproces i det samme rør uden at udskifte reaktionsrøret og den uafhængige DNase I -behandlingsproces. Sammenlignet med den traditionelle metode, der kræver 12-trins drift og 140 min. Reaktion, forenkler det i høj grad driftstrinnene og sparer en masse driftstid.
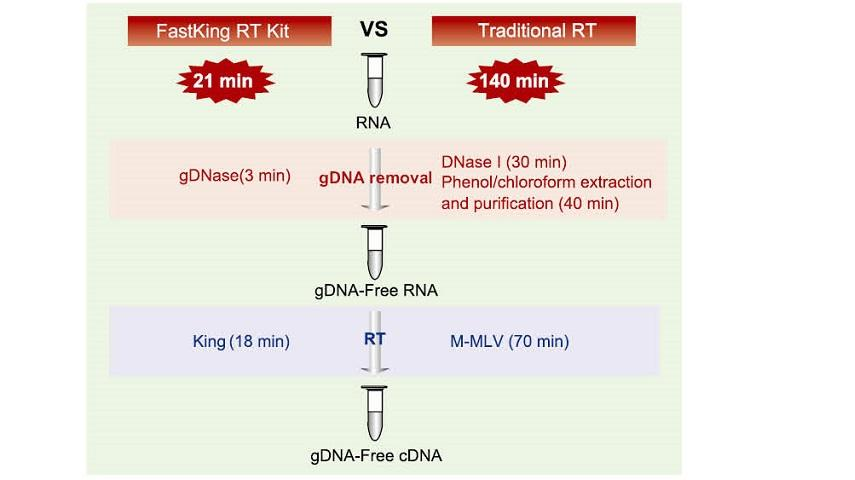
Fremragende kvalitet af King RTase
——Ultra høj reverse transkriptionseffektivitet
- Reverse transkriptionseffektivitet er over 95%
Den generelle revers transkriptase har en revers transkriptionseffektivitet på 40-60%, og cDNA-udbytte kan øges med en højere RNA-belastningsmængde. King reverse transkriptase kan opnå en revers transkriptionseffektivitet på mere end 95% på grund af dens unikke høje affinitet for RNA -skabeloner. Derfor kan efterfølgende eksperimenter opfyldes uden behov for en stor mængde RNA -input, hvilket sparer RNA og muliggør høj renhed og højt udbytte af cDNA.
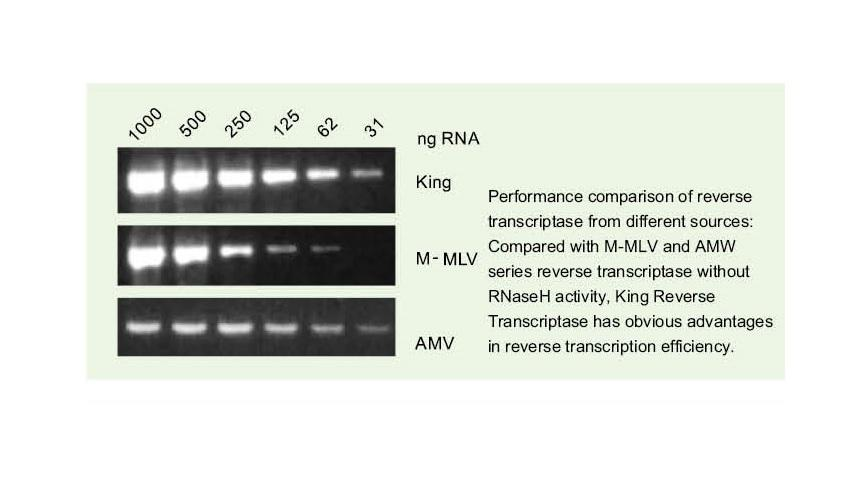
Læs let gennem komplekse skabeloner
—— Let læst igennem høj GC og komplekse skabeloner
Enkeltstrenget RNA har en bred vifte af komplekse sekundære strukturområder på grund af hydrogenbinding mellem tråde. Almindelig omvendt transkriptase kan føre til afslutning af omvendt transkription, når man støder på kompleks sekundær struktur og dermed ikke er i stand til at fuldføre cDNA -syntese. Den nye generation af King reverse transkriptase har imidlertid et unikt strukturelt domæne, som kan ødelægge hydrogenbindingen mellem RNA -tråde og dermed åbne den komplekse sekundære struktur af RNA og sikre den glatte revers transkription.
Alle produkterne kan tilpasses til ODM/OEM. For detaljer,klik venligst på Tilpasset service (ODM/OEM)
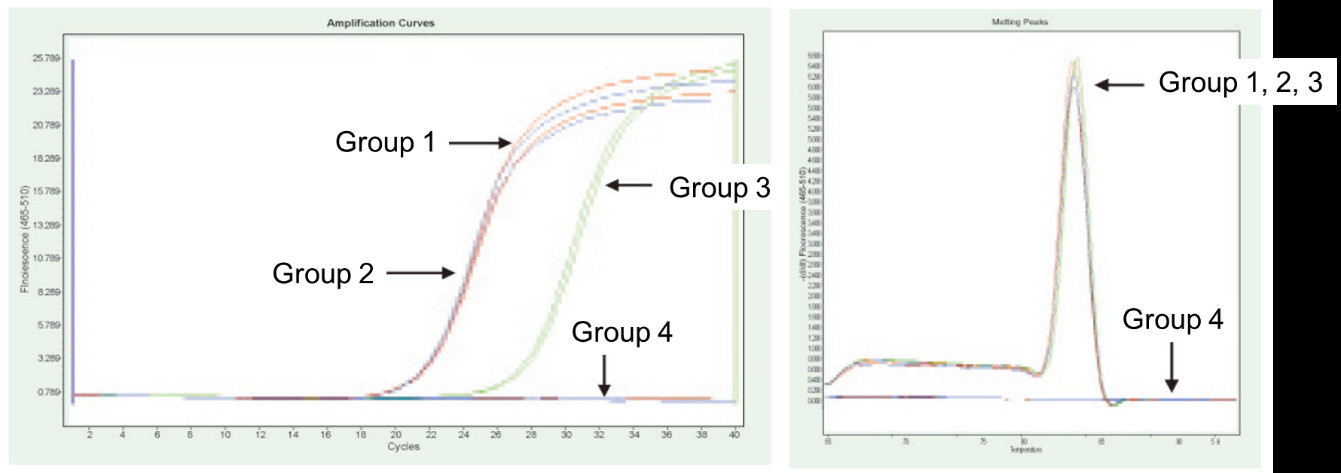 |
Gruppe 1: Omvendt transkription uden gDNase -behandling; Gruppe 2: Ingen gDNase -behandling og ingen revers transkription; Gruppe 3: Omvendt transkription efter gDNase -behandling; Gruppe 4: gDNase -behandling uden revers transkription. Metoder: Fluorescens-kvantitativ PCR-detektion af TNF-alfa-genet (primer designet på exon med cDNA eller genom som skabelon) ved anvendelse af 1 μg Hela-celle-RNA (med genomrester) som skabelon. Resultater: Som vist i figuren kan gruppe 2 reflektere resten af genomet i RNA, gruppe 3 kan nøjagtigt afspejle det sande ekspressionsniveau for TNF-alfa, gruppe 1 har fejl i endelige kvantitative resultater på grund af genomrester, og gruppe 4 viser, at FastKing RT Kit fuldstændigt kan fjerne det resterende genomiske DNA i RNA. |
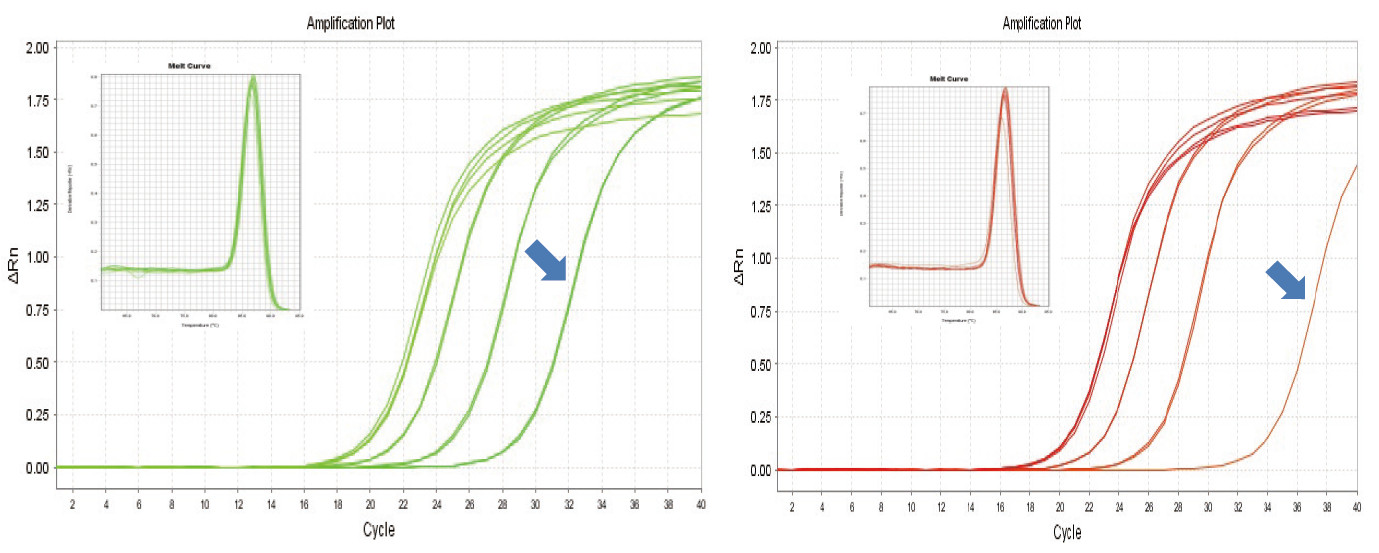 |
Figur 1. Omvendt transkription af mus -RNA blev udført ved hjælp af TIANGEN FastKing RT Kit (til venstre) og relevant produkt fra leverandør A (til højre), derefter blev MM5 -genet kvantitativt amplificeret ved hjælp af TIANGEN SuperReal PreMix Plus (SYBR Green). Amplifikationskurven og smeltekurven blev analyseret. RNA -input var henholdsvis 1000 ng, 100 ng, 10 ng og 1 ng. Resultaterne viser, at TIANGEN FastKing RT Kit har klar revers transkriptionsgradient og lav Ct -værdi og har åbenlyse fordele ved omvendt transskription af skabelon med lav overflod (1 ng, blå pil). |
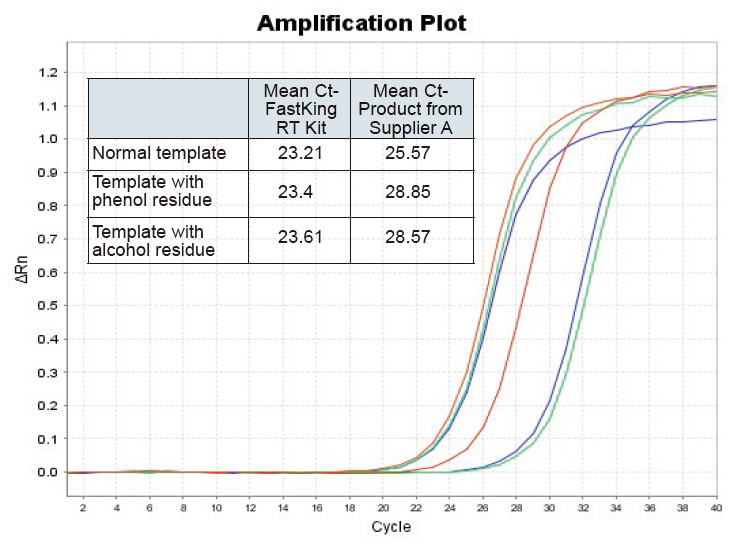 |
Figur 2. Omvendt transkription af normal RNA -skabelon (rød), skabelon med stor phenolrest (grøn) og skabelon med alkoholrest (blå) af rotter ved hjælp af henholdsvis TIANGEN FastKing RT -kit og relevant produkt fra leverandør A, kvantificere RNC -gener ved hjælp af TIANGEN SuperReal PreMix Plus (SYBR Green), og amplifikationskurver og Ct -værdier blev analyseret. Resultaterne viser, at TIANGEN FastKing RT Kit har den laveste kvantitative Ct -værdi efter omvendt transkription og fremragende stressmodstand og har åbenlyse fordele for skabeloner med høje urenhedsrester |
A-1 RNA nedbrydes
—— Rens RNA af høj kvalitet uden forurening. Materialet, hvorfra RNA ekstraheres, skal være så frisk som muligt for at forhindre RNA -nedbrydning. Analyser RNA -integritet på denatureret gel før RT -reaktion. Efter RNA -ekstraktion skal det opbevares i 100% formamid. Hvis der bruges RNase -hæmmer, bør opvarmningstemperaturen være <45 ° C, og pH -værdien skal være mindre end 8,0, ellers frigiver hæmmeren al bundet RNase. Desuden skal RNase -hæmmer tilsættes i opløsninger indeholdende ≥ 0,8 mM DTT.
A-2 RNA indeholder hæmmere af revers transkriptionsreaktioner
—— Reverse transkriptionshæmmere omfatter SDS, EDTA, glycerol, natriumpyrophosphat, spermidin, formamid, guanidinsalt osv. Bland kontrol -RNA'et med prøven, og sammenlign udbyttet med kontrol -RNA -reaktionen for at kontrollere, om der er en inhibitor. Vask RNA -udfældning med 70% (v/v) ethanol for at fjerne inhibitorer.
A-3 Utilstrækkelig udglødning af primere anvendt til syntetisering af den første streng af cDNA
—— Bestem, at udglødningstemperaturen er egnet til de primere, der anvendes i forsøget. For tilfældige hexamerer anbefales det at holde temperaturen ved 25 ° C i 10 minutter, før reaktionstemperaturen nås. For genspecifikke primere (GSP), prøv anden GSP, eller skift til oligo (dT) eller tilfældig hexamer.
A-4 Lille mængde start-RNA
—— Forøg mængden af RNA. For RNA -prøver mindre end 50 ng kan 0,1 μg til 0,5 μg acetyl BSA bruges i den første streng cDNA -syntese
A-5 Målsekvensen udtrykkes ikke i de analyserede væv.
- Prøv andre væv.
A-6 PCR-reaktion mislykkes
—— For totrins RT-PCR kan cDNA-skabelonen i PCR-trinnet ikke overstige 1/5 af reaktionsvolumenet.
A-1 Ikke-specifik glødning af primere og skabeloner
—— 3'-enden af primere bør ikke indeholde 2-3 dG eller dC. Brug genspecifikke primere i syntesen af første streng i stedet for tilfældige primere eller oligo (dT). Brug en højere udglødningstemperatur i de første par cyklusser og derefter en lavere udglødningstemperatur. Brug hot-start Taq DNA-polymerase til PCR for at forbedre specificiteten af reaktionen.
A-2 Dårligt design af genspecifikke primere
—— Følg de samme principper for forstærkning af primer -design.
A-3 RNA forurenet med genomisk DNA
—— Behandl RNA med PCR-grade DNase I. Opret en kontrolreaktion uden omvendt transkription for at detektere DNA-kontaminering.
A-4 Formning af primer dimer
—— Design primere uden komplementære sekvenser i 3' -enden.
A-5 For høj mg2+ koncentration
—— Optimer Mg2+ koncentration for hver skabelon og primer kombination
A-6 Forurenet med fremmed DNA
—— Brug aerosolresistente spidser og UDG-enzymer.
A-1 Indholdet af det første strengprodukt er for højt
—— Reducer mængden af det første strengprodukt i det konventionelle PCR -reaktionstrin.
A-2 For høj primermængde i PCR-reaktion
—— Reducer primer input.
A-3 For mange cyklusser
—— Optimer PCR -reaktionsbetingelser og reducer antallet af PCR -cykler.
A-4 For lav glødetemperatur
—— Forøg udglødningstemperaturen for at forhindre uspecifik initiering og forlængelse.
A-5 Ikke-specifik amplifikation af oligonukleotidfragmenter genereret ved DNase-nedbrydning af DNA —— Ekstrakt RNA af høj kvalitet for at forhindre DNA-kontaminering.
RT-PCR er at revers transkribere RNA til cDNA og derefter bruge det reverse transkriberede cDNA som en skabelon til PCR-reaktion til at forstærke målfragmentet. Vælg enten tilfældige primere, Oligo dT og genspecifikke primere i henhold til eksperimentets specifikke betingelser. Alle de ovennævnte primere kan bruges til kort eukaryot celle -mRNA uden hårnålestruktur.
Tilfældig primer: Velegnet til langt RNA med hårnålestruktur samt alle slags RNA såsom rRNA, mRNA, tRNA osv. De bruges hovedsageligt til RT-PCR-reaktion af enkelt skabelon.
Oligo dT: Velegnet til RNA med PolyA -tailing (prokaryotisk RNA, eukaryotisk Oligo dT rRNA og tRNA har ikke PolyA -haler). Fordi Oligo dT er bundet til PolyA-halen, skal kvaliteten af RNA-prøver være høj, og selv en lille nedbrydning vil i høj grad reducere mængden af cDNA-syntese i fuld længde.
Genspecifik primer: Komplementær til skabelonsekvensen, velegnet til situationer, hvor målsekvensen er kendt.
Der er to måder:
1. Intern referencemetode: I teorien er cDNA DNA -fragmenter af forskellig længde, så resultatet af elektroforese er udtværing. Hvis RNA -overflod er lav, vises intet produkt ved elektroforese, men det betyder ikke, at intet produkt vil blive amplificeret ved PCR. Generelt kan intern reference bruges til at detektere cDNA. Hvis den interne reference har resultater, kan kvaliteten af cDNA grundlæggende garanteres (i nogle få tilfælde, hvis målgenfragmentet er for langt, kan der være undtagelser).
2. Hvis der er et kendt gen amplificeret med denne skabelon, kan det verificeres af primerne af dette gen. Amplifikationen af intern reference betyder ikke nødvendigvis, at der ikke er noget problem med cDNA. Fordi intern reference har stor overflod i cDNA, er den let at amplificere. Hvis cDNA delvist nedbrydes af forskellige årsager, set fra sandsynlighedsperspektivet, vil PCR -resultater af lavgenerative målgener blive stærkt påvirket. Selvom intern reference stadig er høj i overflod, vil amplifikationen sandsynligvis ikke blive påvirket.
Nedbrydes delvis af RNA. Opdag integriteten og rens for RNA
RNA -indholdet af forskellige arter kan være anderledes, men generelt bør det ekstraherede totale RNA indeholde to klare 28S- og 18S -bånd i gelelektroforese, og lysstyrken for det tidligere bånd skal være dobbelt så høj som sidstnævnte. 5S -båndet angiver, at RNA er blevet nedbrudt, og dets lysstyrke er proportional med nedbrydningsgraden. Den vellykkede amplifikation af intern reference betyder ikke, at der ikke er noget problem med RNA, fordi den interne reference er i stor overflod, kan RNA amplificeres, så længe nedbrydningen ikke er alvorlig. OD260/OD280forholdet mellem rent RNA målt ved spektrofotometer bør være mellem 1,9 og 2,1. En lille mængde protein urenhed i RNA vil reducere forholdet. Så længe værdien ikke er for lav, påvirkes RT ikke. Det, der betyder mest for RT, er RNA -integritet.
Udvidelsen af det interne referencegen kan kun indikere, at RT er lykkedes, men det er ikke nødvendigvis relateret til kvaliteten af cDNA -strengen. Fordi de interne referencefragmenter generelt er små i størrelse og højt udtryk, er det lettere at få succes med omvendt transkription. Målgenets størrelse og ekspression varierer imidlertid fra gen til gen. CDNA -kvaliteten kan ikke kun bedømmes ved intern reference, især for målfragmenterne længere end 2 kb.
Nogle prøver har komplekse sekundære strukturer eller har et rigt GC -indhold eller er dyrebare med lav overflod. I disse tilfælde bør passende revers transkriptase vælges i henhold til målfragmentets størrelse og prøven. For RNA -skabeloner med højt GC -indhold og kompleks sekundær struktur er det svært at åbne den sekundære struktur ved lav temperatur eller med almindelig revers transkriptase. For disse skabeloner kan Quant Reverse Transcriptase vælges, da dens revers transkriptionsevne naturligvis er bedre end M-MLV-seriens reverse transkriptase, som kan reversere transskribering af forskellige RNA-skabeloner effektivt og transkribere RNA til cDNA første streng i maksimalt omfang. Ved brug af generelt omvendt transkriptasekit kan 20 pi system kun effektivt reversere transkribering af 1 ug totalt RNA. Vær opmærksom på kitets maksimale RT -kapacitet. Hvis skabelonen tilføjes i overskud, vil revers transkription favorisere RNA med stor overflod. Derfor er det bedre ikke at overskride systemets maksimale kapacitet.
A-1 Bestem om RNA nedbrydes alvorligt, og om RT er vellykket
Generelt er årsagen til den interne referenceforstærkninges fejl ofte forårsaget af alvorlig RNA -nedbrydning. En anden mulig årsag er revers transkriptionsfejl. Intern reference kan ikke bruges som en standard for at bedømme kvaliteten af cDNA -enkeltstreng, men det kan bruges som en standard til at bedømme, om revers transkription er vellykket, hvis der ikke er noget problem med RNA -kvaliteten. Det vigtigste ved omvendt transkription er at opretholde en konstant temperatur og et konstant reaktionssystem for at forbedre reaktionseffektiviteten.
A-2 Bestem, om primerne til amplifikation af interne referencegener er pålidelige, og om der er problemer med reagenser, der anvendes i PCR.
For relativ kvantificering skal RNA kvantificeres før revers transkription, hvilket også er påkrævet i mange reverse transkriptionssæt, f.eks. Kvantificere RNA -input som 1 μg. Da det omvendte transkriberede cDNA er en blandet opløsning, herunder RNA, oligo dT, enzym, dNTP og endda lidt DNA -rest, vil afvigelse blive forårsaget, så det er umuligt at nøjagtigt kvantificere cDNA. Derfor er RNA -kvantificering nødvendig. I betragtning af den omvendte transkriptionseffektivitet er den samme blandt forskellige prøver, bør mængden af opnået cDNA være den samme, og den kvantitative analyse kan vise sammenligning af ekspressionsniveauer for forskellige gener i den samme mængde af totalt RNA. Når der udføres relativ fluorescens kvantitativ PCR, er kvantitativt cDNA muligvis ikke påkrævet efter omvendt transkription, fordi det interne referencegen kan fungere som reference.
Det er hovedsageligt relateret til generne, og omvendt transkription af langt fragment er ikke muligt for de fleste gener. For det første er effektiviteten af omvendt transkription langt lavere end for PCR. For det andet begrænser den GC -rige region og sekundære struktur af mange gener både revers transkription og PCR. Endelig er PCR's loyalitet og forstærkningseffektivitet vanskelig at garantere på samme tid. I processen med omvendt transkription kan ingen garantere at få langt fragment til gener med lav kopi, især ved hjælp af oligo dT. Hvad angår 5 'UTR med mere GC, er det endnu vanskeligere. Derfor er det stadig en rimelig metode til at reversere transkription med tilfældige primere, finde de naturlige spaltningssteder i målfragmentet, forstærke med segmenter og derefter udføre restriktionsfordøjelsen og ligeringen. Generelt er det svært at forstærke fragmenter større end 2 kb direkte, men det er ikke altid umuligt at opnå: 1. Først og fremmest skal du garantere integriteten af RNA/mRNA, og TRIZOL -ekstraktion foretrækkes. 2.M-MLV RT-PCR kit kan bruges direkte. Forlæng udglødningstiden og øg cyklustallet korrekt i forstærkningsprocessen. Alternativt kan indlejret PCR påføres eller udføre en eller to reaktioner først med passende forlænget denaturering og forlængelsestid før normal PCR -forstærkning, hvilket kan hjælpe med at forlænge fragmenter. Vær opmærksom på polymerasens troværdighed. 3.Lang Taq kan bruges i PCR for at opnå ideelle resultater. 4.For proteinekspressionsapplikation bør high fidelity polymerase påføres.
Der er to slags revers transkriptase, der tilbydes af TIANGEN: Quant/King RTase og TIANScript M-MLV. Den største forskel mellem dem er inputmængden af skabeloner. Quant er en unik revers transkriptase, som adskiller sig fra den almindeligt anvendte M-MLV afledt af Moloney murin leukæmivirus. Quant er en ny højeffektiv revers transkriptase rekombinant udtrykt ved konstruktion af Escherichia coli. Quant er egnet til amplifikation af 50 ng-2 μg RNA med høj revers transkriptionel aktivitet og højt udbytte. Sammenlignet med almindelige MMLV eller AMV er Quant's største egenskab, at den har en meget stærk affinitet med RNA -skabeloner og kan reversere transkribering af komplekse skabeloner uden denaturering ved høj temperatur. For skabeloner med højere GC -indhold er den omvendte effektivitet højere. Denne revers transkriptase har imidlertid RNase H -aktivitet, hvilket kan påvirke længden af cDNA -produkt (egnet til <4,5 kb skabeloner). Ved konventionel reverse transkription anbefales TIANScript MMLV reverse transcriptase. Denne RTase er et modificeret enzym med meget svag RNase H -aktivitet, som er egnet til lang (> 5 kb) cDNA -syntese.
Et-trins revers transkription og PCR-amplifikation afsluttes i det samme rør uden at åbne rørdækslet mellem cDNA-syntese og amplifikation, hvilket er nyttigt for at reducere kontaminering. Da alle opnåede cDNA -prøver bruges til amplifikation, er følsomheden højere med et minimum på 0,01 pg total RNA. Til vellykket et-trins RTPCR bruges genspecifikke primere generelt til at starte cDNA-syntese. To-trinsmetoden, nemlig revers transkription og PCR-amplifikation udføres i to trin. For det første udføres omvendt transkription fra en RNA -skabelon for at opnå cDNA, og det opnåede cDNA udsættes for en eller flere forskellige PCR -reaktioner. Metoden i to trin kan bruge oligo (dT) eller tilfældige primere til at styre syntesen af den første streng af cDNA og kan transkribere al mRNA-information fra en bestemt prøve.
Produkter kategorier
HVORFOR VÆLGE OS
Siden etableringen har vores fabrik udviklet produkter i verdensklasse med overholdelse af princippet
af kvalitet først. Vores produkter har opnået et fremragende ry i branchen og er værdifulde blandt nye og gamle kunder.










